Nutrição mineral na produção de mudas de espécies nativas da Caatinga
Introdução
É comum que a produção de mudas florestais seja feita aplicando subsolo como substrato, cuja fertilidade natural é extremamente baixa (SCHUMACHER; CECONI, SANTANA, 2004). Essa prática se reflete em campo, onde problemas nutricionais são recorrentes em espécies tropicais e subtropicais destinadas ao reflorestamento (DRESCHEL; ZECH, 1991), valendo o destaque que, ainda que os sintomas visuais clássicos de deficiências nutricionais não se apresentem, o crescimento das mudas é limitado por restrições do elemento faltante (CARNEIRO, 1995).
Diante disso, percebe-se a clara importância dessa variável na produção de mudas, entretanto as informações necessárias a respeito das exigências nutricionais em espécies florestais nativas são insatisfatórias, sendo raras as espécies das quais se tem conhecimento dos níveis críticos de modo adequado, em função principalmente da ampla variabilidade genética observada nas florestas e à heterogeneidade dos solos das regiões tropicais (SCHUMACHER; CECONI, SANTANA, 2004; CARNEIRO, 1995; FURTINI NETO et al., 1999).
Um dos caminhos para se adquirir essas informações é a análise química da matéria seca de plantas sadias ou parte delas ocorrendo em condição natural, de modo a se determinar as concentrações dos nutrientes inorgânicos essenciais nos seus tecidos, possibilitando a obtenção de parâmetros referência a respeito de exigências nutricionais e assim servindo como subsídio para aplicação de fertilizantes, seja na produção de mudas, seja na cova de plantio (RAVEN; EVERT; EICHHORN, 2010).
Outro caminho seria através de trabalhos que envolvem respostas ao fornecimento de macro e micronutrientes, como observaram Resende et al. (1999) que estudando a resposta de espécies florestais de diferentes grupos sucessionais a diferentes níveis de fornecimento de fósforo, constataram que as pioneiras foram mais responsivas ao fósforo e que o efeito de doses foi variável conforme a espécie (aroeira, aroeirinha, jacaré, sabiá e sesbânia); e Cavalcante et al. (2016), que avaliando o desenvolvimento de mudas de mulungu a partir da fertirrigação com diferentes soluções nutritivas, constataram respostas significativas para todas as características avaliadas, exclusas somente área foliar específica e razão de área foliar.
Caracterização físico-química dos solos da Caatinga.
A litosfera é o estoque da maioria dos elementos químicos necessários para o crescimento e desenvolvimento das plantas, e é fornecedor de material primário para a formação do solo que é a fonte mais importante de nutrientes para os vegetais. (LARCHER, 2004; RAVEN; EVERT; EICHHORN, 2007).
Dos elementos minerais, o mais presente na crosta terrestre é o oxigênio componente de muitos minerais junto ao silício, entre os macronutrientes e micronutrientes, aqueles de maior expressão são, primeiramente, o ferro, seguido de cálcio, magnésio, potássio e fósforo, sendo que os demais constituem uma parcela inferior a 0,1% (LARCHER, 2004).
Com exceção do nitrogênio e do carbono, os demais nutrientes minerais essenciais para as plantas são provenientes da solução do solo, por intermédio da absorção pelas raízes por fluxo de massa, difusão ou interceptação radicular (GUREVITCH; SCHEINER; FOX, 2009; FURLANI, 2004), logo, as características físicas e químicas do solo apresentam-se como uma das principais variáveis necessárias ao desenvolvimento vegetal (FURTINI NETO et al., 1999).
Nas Caatingas, os fatores morfogenéticos que dão origem aos seus solos são explicados principalmente em função de duas formações geológicas principais: rochas pré-cambrianas cristalinas na porção leste, expostos pela erosão geológica que governa, a partir de seu efeito diferencial, a formação de solos que apresentam ampla variabilidade, com profundidades que vão de desde pouquíssimos centímetros a muitos metros; e setores sedimentares que predominam no oeste, principalmente nas figuras da bacia Tucano-Jatobá e zona cárstica do Apodi, sendo que há uma configuração nessas regiões de solos que passaram por um processo intenso intemperismo, mais homogêneos e apresentam comumente boa drenagem e retenção de água. (CUNHA et al., 2010; GARIGLIO et al., 2010).
Quanto à disponibilidade de nutrientes, de maneira geral, os solos da Caatinga são pobres quanto a nitrogênio, pois sua maior porção utilizada pelas plantas é proveniente da ciclagem de nutrientes que é restrita em função da produção limitada de biomassa vegetal (GUREVITCH; SCHEINER; FOX, 2009; SALCEDO; SAMPAIO, 1999).
Os solos de origem sedimentar são geralmente pouco férteis, em função da lixiviação, apresentando deficiências de fósforo e cálcio, exclusas as zonas de origem cárstica no Apodi e entre a Serra Geral e a Chapada da Diamantina, que apresentam alta fertilidade. Já as porções de solos provenientes do escudo cristalino variam entre férteis quando de textura argilosa, aos poucos férteis geralmente de textura mais arenosa, mas, de modo genérico apresentam escassez de fósforo, mas não de potássio, cálcio e magnésio. (MENEZES; GARRIDO; MARIN, 2005; GARIGLIO et al., 2010).
Importância dos nutrientes minerais na produção de mudas florestais.
Os elementos essenciais cumprem inúmeras funções nos vegetais, desde a composição de sua estrutura até a participação no seu metabolismo no exercício suas ações enzimáticas, regulatórias e iônicas. A ausência de qualquer um desses elementos impede que a planta finalize seu ciclo de vida, e esses não podem ser substituídos por outros elementos de propriedades similares (GUREVITCH; SCHEINER; FOX, 2009; RAVEN; EVERT; EICHHORN, 2007; DECHEN; NACHTIGALL, 2006).
De acordo com o teor em que ocorrem nos tecidos vegetais, os nutrientes são classificados em: macronutrientes primários: nitrogênio, fósforo, potássio; macronutrientes secundários: cálcio, magnésio e enxofre, e micronutrientes: boro, cloro, cobre, ferro, manganês, molibdênio, níquel e zinco (RAIJ, 2011).
Embora que, conforme descrito por Liebig (1862), Lei do “Fator Mínimo”, uma substância em menor concentração confira a limitação ao desenvolvimento vegetal, uma elevada concentração de elementos essenciais não deve ser considerada necessariamente a um melhor desenvolvimento, pois a maioria destes elementos é requerida em frações que variam de pequenas a moderadas, resultando em efeitos tóxicos quando em concentrações excessivas. (LARCHER, 2004; RAIJ, 2011; GUREVITCH; SCHEINER; FOX, 2009)
Uma demonstração desse efeito por excesso é relatado por Schumacher, Ceconi e Santana (2004), que estudando a influência de diferentes doses de fósforo no crescimento de mudas de angico-vermelho, observaram que a dose de 450 mg/kg de P resultou no maior crescimento das plantas de Parapiptadenia rígida, entretanto houve redução do crescimento em doses maiores (540 e 630 mg/kg de P); os mesmo autores, em um trabalho semelhante (2003), verificaram que a dose de 360 mg Kg-1 de P resultou no maior crescimento de plantas de Canafístula (Peltophorum dubium (Sprengel) Taubert) mesmo diante da aplicação de doses maiores (450, 540 e 630 mg Kg-1); enquanto Reis et al (2012) constatou que mudas de jacarandá-da-bahia responderam negativamente à adubação potássica para a maioria dos caracteres avaliados no estudo.
Na literatura, vários trabalhos corroboram a tese de Liebig, a partir da técnica do elemento faltante. Souza, Venturin e Macedo (2006) avaliando os efeitos da omissão de nutrientes no desenvolvimento de plântulas de ipê-roxo (Handroanthus impetiginosus (Mart. ex DC.) Mattos) observaram que plantas crescidas no tratamento testemunha tiveram o desenvolvimento afetado em todos os parâmetros avaliados e concluíram que os nutrientes P e N devem ser prioritários aos estudos de fertilização mineral da espécie.
Venturin et al. (2006) avaliando os efeitos da omissão de nutrientes no desenvolvimento de plântulas de candeia (Eremanthus erythropappus (DC.) McLeish), observaram que não houve crescimento das plantas de candeia nos tratamentos-testemunha (substrato natural) e na ausência dos nutrientes P e N;
Silva, Gonçalves e Pinho (2005) avaliando as limitações nutricionais do umbuzeiro (Spondias tuberosa Arr. Câm) observaram que o tratamento testemunha foi inferior aos demais quanto à altura e ao diâmetro, e que as omissões de N, P e Ca foram as que mais limitaram o crescimento em altura e diâmetro das mudas de umbu.
Nitrogênio
O nitrogênio, em termos quantitativos de fitomassa, é o quarto elemento mais abundante nas plantas, estando atrás apenas do carbono, oxigênio e o hidrogênio (LARCHER, 2004; GUREVITCH; SCHEINER; FOX, 2009; RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013). Atua como constituinte de proteínas, aminoácidos, ácidos nucléicos, nucleotídeos, clorofilas e coenzimas (GUREVITCH; SCHEINER; FOX, 2009; RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013), é exigido em altas concentrações, e como consequência, é o elemento mineral que mais limita o desenvolvimento vegetal, de modo que comumente se observam sintomas de deficiência desse elemento (TAIZ; ZEIGER, 2013; SOUZA; FERNANDES, 2006).
Quando a deficiência de nitrogênio é contínua, ocorre clorose generalizada (amarelecimento das folhas), principalmente nas folhas mais velhas. Em situações críticas, as folhas acabam por ficar totalmente amarelas (ou castanhas), e por consequência disso, ocorre a senescência antecipadamente (LARCHER, 2004; RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013). Em folhas mais novas, tais sintomas podem não se expressar tão rapidamente, em razão de que é viável a mobilização do nitrogênio a partir das folhas mais velhas (TAIZ; ZEIGER, 2013).
VIEIRA (2011) estudando o crescimento inicial de espécies florestais perante a omissão macronutrientes, observou que a omissão de nitrogênio em ipê-amarelo reduziu a altura em 16,08%, 21,62% na massa seca da parte aérea e de 17,11% da massa seca das raízes em relação ao tratamento completo, já quanto a Aroeira, no mesmo trabalho, a ausência de N foi uma das que mais limitaram o crescimento das mudas, detectando reduções de 37% quanto à altura e 42,72% quanto ao diâmetro.
A atmosfera terrestre é o grande estoque de nitrogênio, já que é constituída por 78% deste elemento. Porém, grande parte dos seres vivos não consegue utilizar de modo direto o N2 atmosférico. A assimilação do Nitrogênio por plantas é feita a partir de seus compostos mais reativos, como o amônio e o nitrato, provenientes do solo (LARCHER, 2004; RAVEN; EVER; EICHHORN, 2010), ou através de simbiose com bactérias fixadoras de Nitrogênio, característica da família Fabaceae (GUREVITCH; SCHEINER; FOX, 2009).
Existe uma pequena contribuição do nitrogênio no solo por intermédio do arraste pela chuva de seus óxidos formados na atmosfera por descargas elétricas, outra porção advém da ciclagem da biomassa em decomposição, entretanto, a maior parte do N disponível para as plantas é de responsabilidade do processo de fixação biológica de nitrogênio envolvendo aenzima nitrogenase presente em bactérias (RAVEN; EVER; EICHHORN, 2010; GUREVITCH; SCHEINER; FOX, 2009; SOUZA; FERNANDES, 2006).
A fixação do nitrogênio é executada por microrganismos procariotos que convertem nitrogênio atmosférico em NH4+ (amônio), assimilável pelas plantas através da quebra de ligações triplas que existem entre os dois átomos do componente gasoso. Esses seres podem viver de modo livre ou como simbiontes nas raízes de algumas espécies de plantas. As simbioses de fixação de nitrogênio mais comuns são aqueles existentes entre as bactérias do gênero Rhizobium e Bradyrhizobium e os membros das Fabaceae (leguminosas) formando nódulos em suas raízes, entretanto também pode ocorrer na rizosfera de gramíneas (GUREVITCH; SCHEINER; FOX, 2009; LARCHER, 2004; SOUZA; FERNANDES, 2006).
Potássio
O potássio (K) é o segundo macronutriente mais abundante nas plantas, compondo entre 0,5 e 6% da massa seca total (RAIJ, 2011; GUREVITCH; SCHEINER; FOX, 2009), sendo o cátion de maior concentração no citoplasma das células dos vegetais (FURLANI, 2004).
Na condição natural, a absorção do potássio ocorre na sua forma iônica (K+), dependendo da difusão do elemento, através da solução do solo, e em menor intensidade, do fluxo de massa. A exigência de potássio pelas plantas depende da espécie, e do seu estádio de crescimento (MEURER, 2006; RAIJ, 2011).
O potássio participa de múltiplos processos fisiológicos, como a regulação osmótica, o equilíbrio iônico; a manutenção de água por meio do controle da abertura estomática; o alongamento e estabelecimento do turgor celular; a síntese de proteínas, carboidratos e ATP; otransporte de açúcares no floema; a resistência a doenças, bem como a geada, seca e salinidade; além de contribuir na ativação de inúmeras enzimas, muitas delas participante dos processos de respiração e fotossíntese. (FURLANI, 2004; MEURER, 2006; RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013; ERMANI, et al., 2007; MALAVOLTA, 1980).
Silva et al. (2013) observando a influência na qualidade de mudas de cedro doce (Bombacopsis quinata) a partir do fornecimento de potássio e calcário, constatou que as doses de potássio determinaram incrementos positivos nas variáveis altura da parte aérea, comprimento da raiz, diâmetro do coleto, biomassa fresca e seca da parte aérea e da raiz, bem como, no índice de qualidade de Dickson (IQD).
O primeiro indício perceptível de deficiência de potássio é a clorose em manchas ou marginal, que progride para necrose, e ocorre com mais frequência nos ápices foliares, nas margens e entre nervuras. Tais sintomas apresentam-se a princípio nas folhas mais velhas, pelo fato de que o potássio pode ser remobilizado para as folhas mais jovens (RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013).
Barroso et al (2005), em trabalho no diagnóstico de deficiências de macronutrientes em mudas de Tectona grandis, relataram que quando as mudas foram sujeitas a abstenção de potássio, ocorreu diminuição do desenvolvimento, clorose entre nervuras, encarquilhamento e manchas de necrose nas folhas mais velhas.
Cálcio
A deficiência de Cálcio é rara em condições de campo, sendo relacionado positivamente as frações de silte e argila. Sua demanda é de ampla variação entre as espécies, sendo exigido os limites de 10 kg/ha até 200 kg/ha nos solos onde ocorre na forma de carbonatos, sulfatos e silicatos, valores este que se refletem em seu teor nos tecidos foliares, ocorrendo desde valores inferiores a 4 g/kg e até cerca de 40 g/kg para plantas sadias. (RAIJ, 2011; VITTI; LIMA; CICARONE, 2006; FAQUIN, 2006; CARNEIRO, 1995).
O cálcio é absorvido pelas raízes em forma de Ca2+, podendo essa absorção ser limitada em virtude da competição em altas concentrações de outros cátions necessários a planta, como o K+, Mg2+ e NH4+. (VITTI, LIMA; CICARONE, 2006; FAQUIN, 2006), conforme observado por Moretti et al. (2011) que trabalhando com nutrição mineral de mudas de cedro australiano (Toona ciliata) verificou que o teor de Ca foi maior nos tratamentos com omissão de K, N, S e P.
O cálcio é integrante da lamela média da parede celular onde se encontra em alta proporção, função que se acredita torná-lo indispensável para a germinação e síntese do tubo polínico; tem papel na absorção iônica, favorecendo a absorção de nutrientes, na medida que, ao corrigir o efeito desfavorável por excesso de concentração hidrogeniônica; é requerido para o alongamento e divisão celular (FAQUIN,2006; VITTI; LIMA; CICARONE, 2006; MALAVOLTA, 1980)
O cálcio é distribuído ascendentemente pelo xilema principalmente por reações de troca entre os vasos condutores, entretanto nas folhas sua mobilidade é pequena devido à sua concentração no floema ser baixa, somente sendo redistribuído mediante condições específicas. (FAQUIN, 2006; MALAVOLTA,1980; RAIJ, 2011)
Sua deficiência é reconhecida pela necrose nas regiões meristemáticas jovens nos ápices de raízes ou de folhas jovens. Nas raízes, cessa-se o crescimento, há escurecimento e posterior morte; folhas jovens tornam-se cloróticas e deformadas, sendo que as folhas jovens podem ter a aparência de deformada; em leguminosas, as nodulações necessitam mais do elemento em si, quando em comparação ao indivíduo por inteiro, de modo que, formado os nódulos, a planta possa se desenvolver em concentrações reduzidas de cálcio (TAIZ;ZEIGER 2013; RAIJ, 2011; MALAVOLTA, 1980).
Magnésio
No solo, o magnésio ocorre em sua forma iônica Mg2+, forma na qual pode ser absorvido pelas plantas (RAIJ, 2011; VITTI; LIMA; CICARONE, 2006), tendo sua origem primária em rochas ígneas e sendo constituinte de minerais como a biotita, dolomita, clorita, serpentina e olivina, componentes também de rochas metamórficas e sedimentares (FAQUIN, 2006).
O Mg é parte da estrutura em anel da molécula da clorofila, uma porfirina magnesiana, correspondendo a 2,7% de seu peso molecular; é o principal ativador enzimático, ativando mais enzimas que qualquer outro elemento; envolvido no balanço cátion/ânion; regulação do citoplasma; e participa da entrada de fósforo na planta (TAIZ; ZEIGER, 2013;VITTI; LIMA; CICARONE, 2006; GUREVITCH; SCHEINER; FOX, 2009).
A demanda do elemento pelas plantas é relativamente pequena, compõe apenas entre 1 e 0,8% de sua massa total (RAIJ, 2011; GUREVITCH; SCHEINER; FOX, 2009), há uma semelhança, referente a sua absorção quanto ao K, sendo a via de fluxo por massa responsável pela maior parcela do contato do magnésio com a raiz. Sua absorção é influenciada pelo teor de K e de outros cátions (VITTI, LIMA. CICARONE, 2006).
Esse fenômeno é relatado por Souza, Venturin e Macedo (2006) avaliando a nutrição mineral de ipê-roxo a partir da técnica do elemento faltante, onde o teor de Mg foi maior no tratamento com a omissão de K e N, bem como por Barroso et al (2005) em trabalho semelhante em Teca, observando que na ausência de K houve aumento dos teores de Mg na parte aérea.
Os sintomas de deficiência de magnésio são a clorose amarelada, bronzeada ou avermelhada entre as nervuras foliares que permanecem verdes, observando-se primeiramente em folhas mais velhas, visto a possibilidade de redistribuição do elemento, em virtude, de sua mobilidade. Em níveis elevados de déficit, as folhas podem ficar amarelas ou brancas, outro sintoma bastante notório é a abscisão foliar prematura. (TAIZ; ZEIGER, 2013; VITTI; LIMA; CICARONE, 2006). Sintomas semelhantes foram registrados em Tectona grandis (BARROSO, et al., 2005), Khaya anthotheca (VIEIRA ; WEBER; SCARAMUZZA, 2014) e Amburana acreana (VIEIRA, et al., 2011), nesse trabalhos também foi observado um aspecto ondulado nas bordas das folhas.
Fósforo
O fósforo é fundamental para a transferência de energia, a partir de suas ligações com açúcares, com o gliceraldeído e com as coenzimas AMP, ADP, ATP, UTP e GTP, bem como seu armazenamento; constitui ácidos nucléicos, fosfato-açúcares, intermediários da respiração e fotossíntese, e fosfolipídios que compõe as membranas vegetais; em sua forma iônica. O fósforo é um elemento regulador de diversas vias sintéticas (TAIZ; ZEIGER, 2013; GUREVITCH; SCHEINER; FOX, 2009; FURLANI, 2004); e, em condições de concentração adequadas, é estimulante ao desenvolvimento radicular, é fundamental na formação de frutos, sementes e fomenta a precocidade produtiva (RAIJ, 2011).
De todos os elementos cujo principal fornecedor é a rocha intemperizada, o fósforo é aquele que mais limita o crescimento vegetal. Na Austrália, por exemplo, a distribuição das comunidades vegetais nativas é comumente delimitada pela presença de fosfato (RAVEN; EVERT; EICHHORN; 2010), embora seus teores nas plantas sejam consideravelmente inferiores quando comparados a nitrogênio e potássio, variando entre 1 e 0,8% da massa total dos tecidos (RAIJ, 2011; GUREVITCH; SCHEINER; FOX, 2009).
Solos formados a partir de rochas calcárias ricas em fosfato comumente possuem maiores quantidades de fosfato, assim como aqueles inseridos em regiões áridas e semiáridas, em virtude de suas principais perdas serem decorrentes da erosão e da lixiviação. Solos que derivam de arenitos e rochas ígneas ácidas são deficientes quanto a esse elemento (RAVEN; EVERT; EICCHORN; 2010; GUREVITCH; SCHEINER; FOX, 2009).
Plantas em déficit de fósforo apresentam crescimento reduzido quando jovens, as folhas velhas, por consequência da mobilidade do nutriente para tecidos mais jovens, podem apresentar má formação e manchas necróticas, bem como coloração arroxeada em função de excessos de antocianina, também são observadas reduções na área, número de folhas e redução em sua expansão, que por não ser acompanhada de reduções nos processos de formação da clorofila e dos cloroplastos conferem às folhas velhas coloração verde-escura (FURLANI, 2004; TAIZ; ZEIGER, 2013; RAVEN; EVERT; EICCHORN; 2010).
Souza et al. (2006), em estudo sobre adubação mineral do ipê-roxo, observaram que o crescimento da parte aérea e radicular das mudas, quanto à matéria seca, foi reduzido pelo déficit de N e P, e a relação raiz/parte aérea foi mais afetada na ausência de P.
O fósforo é absorvido pelas raízes preferencialmente na forma H2PO4– e tem por singularidade seu alto grau de interação com o solo, ligando-se ao húmus e aos colóides minerais, de modo que, tanto na forma de fosfato orgânico como inorgânico podem se tornar indisponíveis para absorção pelas raízes, ainda que, na planta, o elemento apresente alta mobilidade (GUREVITCH; SCHEINER; FOX, 2009; RAVEN; EVERT; EICHHORN, 2010; RAIJ, 2011).
Em função dessa interação com as partículas do solo, conferindo-lhe baixa mobilidade, há uma relação estreita entre o comprimento radicular com a absorção de fósforo, em virtude, da maior área de contato de sistemas mais extensos com o solo (ARAÚJO; MACHADO, 2006).
Outro adicional a essa área de contato, está nas associações entre fungos e raízes, as chamadas micorrizas, uma relação comumente simbiótica mutualista e não-específica, podendo ser encontradas em praticamente todas as plantas terrestres desde gimnospermas e angiospermas, até algumas briófitas e pteridófitas (ARAÚJO; MACHADO, 2006; GUREVITCH; SCHEINER; FOX, 2009).
Enxofre
O enxofre (S) é absorvido pelas plantas na sua forma oxidada, sulfato (SO42), contido na solução do solo, porém, para que ocorra sua assimilação, é necessário que o sulfato seja reduzido para sulfeto S2-. Pesquisas têm apresentado evidências de que os estômatos das folhas realizam a absorção e metabolizam o SO2 atmosférico, no entanto, tais processos não são muito efetivos (FAQUIN, 2005).
Na fisiologia vegetal o S é detectado em aminoácidos (cistina, cisteína e metionina), e é componente de coenzimas e vitaminas, como coenzima A, S-adenosilmetionina, biotina, vitamina B1 e ácido pantotênico (RAIJ, 2011; TAIZ; ZEIGER, 2013).
A deficiência de S anula a produção de proteínas, causa clorose, redução do crescimento e acúmulo de antocianinas, tal como pode ser observado em plantas com deficiência de nitrogênio. Porém, quando há ausência de enxofre, primeiramente, é comum observar clorose nas folhas jovens e velhas, diferente do que se verifica em casos de deficiência de nitrogênio, quando os sintomas incidem inicialmente nas folhas maduras, isso ocorre, pois, em grande parte das espécies, não é possível a remobilização do enxofre para as folhas mais jovens. Em outras, observa-se que a clorose por ausência de enxofre, se apresenta paralelamente em todas as folhas, podendo até ocorrer primeiramente nas folhas mais novas (RAIJ, 2011; TAIZ; ZEIGER, 2013).
Barroso et al (2005), em seu trabalho no diagnóstico de deficiências de macronutrientes em mudas de Tectona grandis, relataram que, quando houve a ausência de enxofre, as plantas mostraram restrição no desenvolvimento e clorose em todas as folhas, principalmente nas folhas novas, que exibiram crescimento reduzido, endurecimento e leve encarquilhamento.
Sarcinelli et al (2004), trabalhando nos sintomas de deficiência nutricional em mudas de Acacia holosericea em resposta à omissão de macronutrientes, constataram os seguintes sintoma em déficit de enxofre: limitação na produção de matéria seca vegetal, clorose dos filódios mais novos e gemas e alteração na arquitetura natural da planta, com os filódios apontados para o alto, ou seja, aproximando-se de uma posição paralela ao caule (diminuição do ângulo de inserção dos filódios ao caule).
Micronutrientes
Boro
O boro interfere na absorção de cátions, principalmente o cálcio, na produção de ácidos nucléicos, especificamente por envolvimento na síntese da uracila, além de atuar no funcionamento da membrana facilitando o transporte de açúcares e na estrutura da parede celular, local em que se encontra a maior parte desse elemento na célula, interligando seus polímeros, bem como, participa do metabolismo das auxinas (RAVEN; EVER; EICHHORN, 2010; MARENCO; LOPES, 2013; FAQUIN, 2005; DECHEN; NACHTIGALL; 2006).
Há uma variedade de sintomas de déficit de boro, plantas jovens absorvem boro com maior facilidade que plantas velhas; outra questão observada é que é mais comum a deficiência em solos arenosos e há uma limitação na translocação do elemento dos tecidos velhos para os jovens, de modo que os sintomas sejam observados primariamente nos tecidos jovens (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013; DECHEN; NACHTIGALL; 2006).
De modo geral, a carência do B resulta na falha no alongamento das raízes, em necrose na base da lâmina foliar de folhas jovens e nas gemas terminais, os caules adquirem uma rigidez incomum e se tornam quebradiços. Em alguns casos, a dominância apical se torna inexistente, resultando em plantas bastante ramificadas, porém devido à ausência da divisão celular, os ápices terminais dos ramos apresentam necrose (RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013).
Níquel
Este elemento é componente da enzima urease, que proporciona a quebra da ureia em amônio e CO2, portanto, se ocorre o déficit de níquel, há o acúmulo de ureia nas folhas, ocasionando necrose nos ápices foliares (DECHEN; NACHTIGALL, 2007; RAVEN; EVER; EICHHORN, 2010; TAIZ; ZEIGER, 2013). Sendo assim, é indispensável a presença do níquel em plantas que recebem adubações com ureia e seus derivados (DECHEN; NACHTIGALL, 2007; RAVEN; EVER; EICHHORN, 2010).
Molibdênio
O molibdênio é o micronutriente que ocorre em menores proporções no solo, e tem sua principal atuação como constituinte de várias enzimas de papéis importantes como: a nitrato-redutase, que participa da redução do íon NO3– a NO2–, ou seja, há um acúmulo de nitrato na planta em caso de déficit de Mo, de modo que, os sintomas de deficiência desse elemento, assemelhem-se as do nitrogênio; outra é a nitrogenase presente em bacteroides nodulares responsáveis pela fixação do nitrogênio atmosférico, logo, no sentido do metabolismo do nitrogênio, o molibdênio não é indispensável às plantas, desde que seja fornecido amônio; entretanto, o elemento encontra sua essencialidade na presença nas enzimas xantina desidrogenase, importante no catabolismo das purinas, bem como uma oxidase atuante na síntese do ácido abscísico (TAIZ; ZEIGER, 2013, RAIJ, 2011; DECHEN; NACHTIGALL, 2007; MARENCO; LOPES, 2013).
A principal evidência de deficiência é a clorose internerval, a necrose marginal, e o encurvamento de folhas mais velhas (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013). Outros efeitos são a interrupção do florescimento, bem como, a senescência dessas flores, e observam-se reflexos negativos a síntese de ácido ascórbico, conteúdo de clorofila e atividade respiratória quando esse nutriente está em falta (TAIZ; ZEIGER, 2013; DECHEN; NACHTIGALL, 2006).
Zinco
Inúmeras enzimas requerem íons de zinco atuando como co-fator em suas atividades, ativa desidrogenases, aldolases, enolases, isomerases, peptidases, transfosforilases e RNA e DNA polimerases, ou seja, muito influente no metabolismo dos açúcares e na síntese protéica. (MARENCO; LOPES, 2013; TAIZ; ZEIGER, 2013).
A deficiência de zinco é uma questão mundial, mas há um destaque em solos calcários de clima árido e semiárido, pois, o bicarbonato limita a absorção desse elemento. (MARENCO; LOPES, 2013).
Plantas com déficit apresentam atraso e redução do crescimento, folhas pequenas, retorcidas, entrenós curtos, o que é mais intenso em algumas espécies, e confere a formação de folhas em roseta, resultado da baixa atividade da gema terminal. (TAIZ; ZEIGER, 2013; DECHEN; NACHTIGALL, 2006).
Cobre
O cobre tem por principal função fisiológica a participação em sistemas de oxirreduções como componente de enzimas como a citrocomo oxidase da cadeia transportadora de elétrons, a superóxido dismutase que atua na destoxificação de radicais dos superóxidos, ascorbato oxidase e da plastocianina, uma proteína, que se encontra nos cloroplastos, e é envolvida no transporte de elétrons de reações da fotossíntese, da qual o cobre contribui em 50% na constituição. (TAIZ;ZEIGER,2013; MARENCO; LOPES, 2013).
Em deficiência de cobre, observa-se a emissão de folhas verde-escuras, que podem apresentar manchas necróticas, inicialmente ocorrendo no ápice das folhas jovens e logo em seguida se estendem em direção à base da folha, ao longo das margens, resultando na senescência foliar em estágios mais avançados (TAIZ; ZEIGER, 2013).
Outros sintomas que podem ocorrer consistem nas folhas ficarem retorcidas ou malformadas, bem como os galhos e hastes se curvarem ou entortarem, em função da lignificação defeituosa da parede celular, pela participação do cobre na atividade das enzimas polifenol oxidase, que oxida precursores da lignina, e a diamina oxidase. (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013).
Manganês
O manganês tem participação na reação de Hill do processo de fotossíntese, pela qual o oxigênio é produzido a partir da água, bem como, tem atuação como ativador enzimático de diferentes sistemas como as descarboxilases e desidrogenases do ciclo de Krebs (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013).
O sintoma mais característico de sua deficiência é a clorose internerval associada a manchas necróticas, ocorrendo em folhas jovens ou nas mais velhas, conforme espécie e taxa de crescimento (TAIZ; ZEIGER, 2013; DECHEN; NACHTIGALL, 2007).
Ferro
O ferro está ligado a enzimas que transferem elétrons como os citrocomos da cadeia transportadora, a catalase, peroxidase e a xantina oxidase atuante no metabolismo das purinas, nos tecidos foliares encontra-se 80% do ferro nos cloroplastos e plastídios (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013).
Em déficit, provoca clorose internerval, pois apesar de não compor a clorofila, participa de sua síntese, e em folhas jovens, pois não é móvel, de modo que, caso não haja um fornecimento do nutriente no decorrer do tempo as nervuras podem se tornar cloróticas tornando a folha branca (TAIZ; ZEIGER, 2013; MARENCO; LOPES, 2013).
Cloro
O cloro é essencial na clivagem das moléculas de água, para liberação de O2 por cloroplastos no fotossistema II, mas é encontrado em grandes concentrações nos vacúolos, logo, atua na osmorregulação e manutenção do turgor (MARENCO; LOPES, 2013; DECHEN; NACHTIGALL, 2007).
Há um progresso de sintomas no déficit de cloro, que inicia com murcha dos ápices das folhas seguidas de clorose e necrose generalizadas, podendo as folhas adquirirem um aspecto bronze em sua coloração (TAIZ; ZEIGER, 2013).
Análise do Solo
Amostragem
Analisar todos os elementos de uma população de interesse corriqueiramente é impraticável, entretanto, ferramentas estatísticas possibilitam a generalização segura de informações sobre a população a partir de amostras que a representem. Para isso, uma das formas é que o processo de amostragem tenha base em coletas de dados aleatórias.
Solos são materiais extremamente heterogêneos, as variações em suas propriedades podem ocorrer em um intervalo de poucos centímetros (RAIJ, 2011). O processo de amostragem em solos é a etapa inicial e fundamental no programa de correção e adubação (VELOSO et al, 2006). Para que este represente a fertilidade da área, a coleta deverá executada criteriosamente, de modo que os resultados analíticos correspondam factualmente às características e propriedades do terreno (UFC, 1993).
A propriedade deverá ser dividida em subáreas, chamadas glebas, semelhantes quanto vegetação, produtividade, histórico de tratamentos corretivos e fertilizante e o solo, considerando sua cor, textura da camada superficial, posição topográfica e as condições de drenagem, de cada gleba devem ser retirar de 10 a 20 amostras simples, de mesmo volume (RAIJ, 2011; UFC, 1993).
A coleta das amostras para a análise de fertilidade devem ser realizadas na camada superficial (0 a 20 cm de profundidade) e área escolhida deve ser percorrida em ziguezague e coletadas várias subamostras em diferentes pontos.
Para retirada das amostras, podem ser utilizados enxada, pá de repicagem, trado holandês ou de rosca, enxadão ou pá, entretanto, o mais indicada é o uso trado, pois padroniza a profundidade com os mesmos volumes de terra, outros itens necessários são sacos plásticos limpos, devidamente etiquetados, e um balde de plástico limpo (VELOSO et al, 2006).
Sugere-se, adotando o mesmo critério, amostrar o subsolo (20 a 50 cm de profundidade em casa de implantação, principalmente de culturas perenes em áreas até então não exploradas, bem como, em áreas sobre as quais se suspeita de problemas químicos no subsolo (UFC, 1993).
Resultados
Comumente, os laboratórios ofertam um conjunto restrito de análises, chamadas de análises de rotina de fertilidade, pois podem ser executadas rotineiramente e em larga escala, onde constam as dosagens de pH, MO, P, K+, Na+, Ca2+, Mg2+, Al3+ e H+Al (VELOSO et al, 2006) Podendo ser solicitado a dosagem adicional de N total, N-NO3-, N-NH4+ , S-SO42- e micronutrientes. Esses valores permitem o cálculo da:
- Soma de bases trocáveis (SB) a partir do somatório dos teores de K++Na++Ca2++Mg2+.
- Capacidade de troca efetiva (CTC efetiva ou t) a partir do somatório de SB+Al+3.
- Capacidade de troca catiônica a pH 7,0 (CTC a pH 7,0 ou T): dada pela soma SB+ H+Al.
- Volume de saturação por bases (valor V): dado por 100 x SB/T, em %.
- Saturação por alumínio trocável (valor m): dado por 100 x Al3+/t, em %.
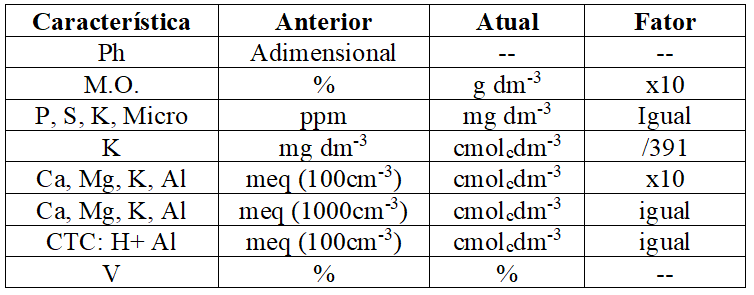
Atualmente nos resultados das análises de solo é adotado o Sistema Internacional de Unidades. No Quadro 1 são apresentados, segundo Veloso et al. (2006), os fatores de correção caso não tem sido implantado esse sistema no laboratório onde foram feitas as análises:
Quadro 1 Conversão de unidades empregadas em relatórios de análises de solos (Veloso et al., 2006).
Interpretação
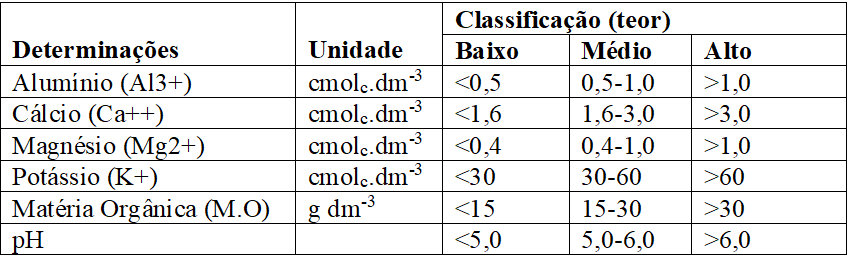
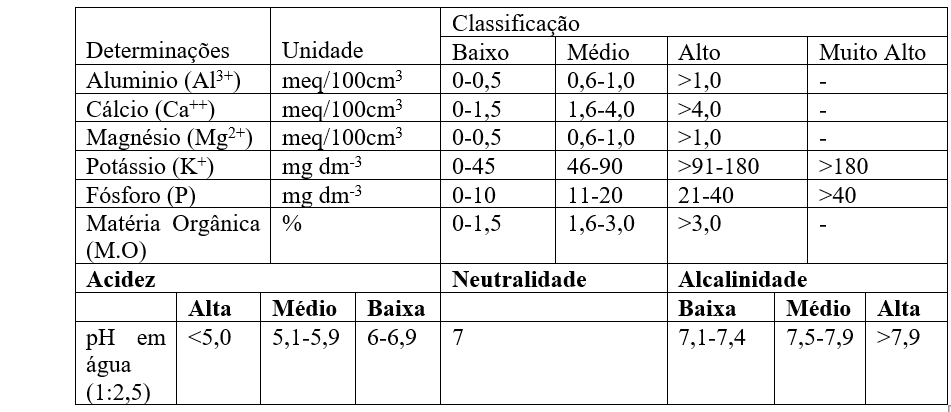
A análise de solos fornecerá as bases para a correção e a adubação, a fim de manter os teores dos elementos em faixas ideais e obter retorno econômico mais favorável possível (RAIJ, 2011). No Quadro 2, são mostrados os valores que são utilizados para interpretar resultados de análise de solo segundo Veloso et al. (2006), e no Quadro 3, os valores usados para interpretação dos níveis de fertilidade no estado do Ceará, segundo Universidade Federal do Ceará, (1993):
Quadro 2 Valores utilizados para interpretar resultados de análise de solo (Veloso et al., 2006).
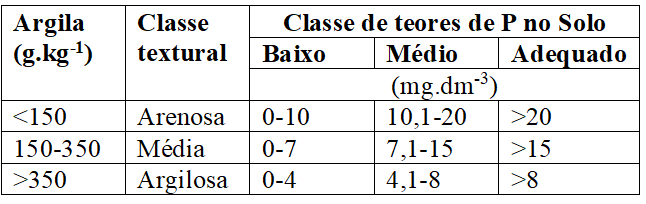
O teor de fósforo no solo (Quadro 4), segundo, Veloso et al. (2006), é estimado pelo extrator Mehlich-1 e sua interpretação considera o teor de argila, logo, em solos arenosos o nível crítico é mais alto que em solos argilosos, de modo que temos, em função do teor de argila que:
Quadro 3 Níveis de fertilidade para interpretação dos Resultados da Análise do Solo Utilizados pelo laboratórios do estado do Ceará.
Quadro 4 Classes de teores de P no solo conforme a classe textural (Veloso, 2006).
Adubação
Em tese, os elementos imprescindíveis à vida e a produção vegetal são: luz, água, ar, temperatura adequada, bem como os macro e micronutrientes. Em virtude disso, o desenvolvimento vegetal é possível em soluções aquosas que fornecem os nutrientes, conforme as exigências da cultura, em ambientes com disponibilidade de ar, luz e temperatura adequados, essas soluções são as chamadas soluções nutritivas. Não é, portanto, o solo indispensável ao desenvolvimento vegetal, mas fundamental para sua produção em larga escala (ALCARDE, 2007; COMETTI, et al., 2006).
Quanto à nutrição, os solos podem ser pobres ou ricos, e estes tendem a ser exauridos no decorrer de seu uso impróprio para fins agrícolas, de modo que, para suprir as necessidades das plantas seja necessário o fornecimento desses nutrientes por intermédio da adubação, que pode ser mineral ou orgânica, natural ou sintética (RAIJ, 2011; ALCARDE, 2007).
O estado nutricional deve ser uma preocupação do viverista, é necessário se conhecer as fontes de fertilizantes, bem como os níveis críticos de cada espécie, déficits mesmo perante ausência de sintomas visuais, mas que limitam o desenvolvimento, e excessos, que podem tornar nutrientes indisponíveis ou gerar efeitos tóxicos (CARNEIRO, 1995).
Adubação Mineral: Fontes e Efeitos.
A adubação mineral é a realizada por intermédios de compostos inorgânicos ou compostos orgânicos sintetizados industrialmente como a ureia, sendo considerado simples, quando constituídos de um único composto químico contendo um ou mais nutrientes, ou complexos, quando formados por dois ou mais compostos, e mistos, quando resultado da mistura física de outros tipos de adubos (SILVA; LOPES, 2011; ALCARDE, 2007).
Adubos nitrogenados
A maior parte dos adubos nitrogenados fabricados usa amônia (NH3) como matéria prima básica, os mais usados no Brasil são a ureia, o nitrato de amônio, o sulfato de amônio, nitrato de cálcio, os fosfatos de amônio e o salitre do Chile, produto natural, composto em maior proporção por NaNO3, de pouca importância atualmente (RAIJ, 2011; MALAVOLTA, 1980).
As especificações mínimas exigidas pelo MAPA (2007), exceto para salitre do Chile, para comercialização desses adubos, encontram-se no Quadro 1:
Quadro 5 Especificações mínimas exigidas pelo MAPA (2007) para comercialização de adubos nitrogenados (exceto salitre do Chile).
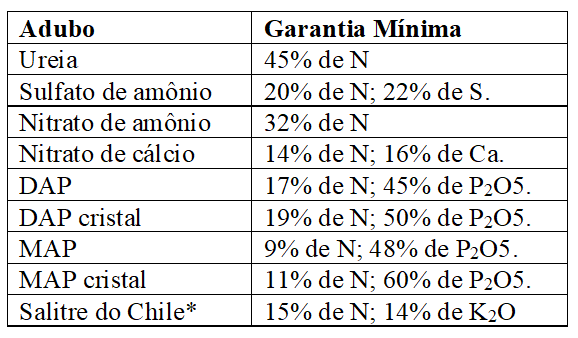 * Produto comercial – salitre potássico. Contém 18% de sódio.
* Produto comercial – salitre potássico. Contém 18% de sódio.
A ureia é o mais importante adubo nitrogenado, considerada uma das melhores alternativas para suprimento de nitrogênio, entretanto, possui restrições decorrentes da perda de nitrogênio por volatização e efeitos fitotóxicos pela presença de biureto como impureza no composto, bem como, de sua higroscopicidade, que confere propriedades físicas indesejáveis; enquanto o sulfato de amônio é dotado de excepcionais propriedades físicas em virtude de sua reduzida higroscopicidade, além dos altos teores de enxofre, mas o fertilizante além do baixo teor de N, tem potencial de acidificação; caso que não ocorre no nitrato de cálcio, mas, este, tem alto custo e higroscopicidade, bem como, possui baixos teores de N; já quanto ao nitrato de amônio, seu comércio em forma pura é proibido em alguns países, em virtude do potencial explosivo diante de substâncias orgânicas que oxidam facilmente e as misturas reduzem o teor de nitrogênio (RAIJ, 2011; MALAVOLTA, 1979).
As diferentes características de cada fonte refletem-se em campo. Marques et al. (2006), estudando a resposta da adubação nitrogenada sobre mudas de jacarandá-da-bahia (Dalbergia nigra (Vell.) Fr. All. ex Benth.) cultivados em três tipos de solo (Argissolo Vermelho-Amarelo, Cambissolo e Latossolo Vermelho-Amarelo), a partir de diferentes doses (0, 50, 100, 150 e 200 mg/dm³ de N) aplicadas aos 25, 50, 75 e 100 dias após a semeadura e fontes do elemento (nitrato de amônio, nitrato de cálcio e sulfato de amônio) constataram que aos 125 dias após a semeadura, que dentre as fontes nitrogenadas testadas, o sulfato de amônio foi a fonte que proporcionou os melhores resultados, apresentando efeitos positivos e significativos sobre a altura da parte aérea, o diâmetro do coleto, a relação altura da parte aérea/diâmetro do coleto, o peso de matéria seca da parte aérea, o peso de matéria seca das raízes, o peso de matéria seca total e o índice de qualidade de Dickson.
Em trabalho semelhante, Marques et al. (2009) relataram resultados semelhantes em mudas de jacaré (Piptadenia gonoacantha J.F. Macbr.), em que a aplicação do sulfato de amônio levou a ganhos em crescimento das mudas, apresentando as melhores médias de todos os parâmetros morfológicos, com exceção das relações entre as características avaliadas, adquiridas com aplicação variando de 151 a 200 mg/dm3 de N, o sulfato de amônio também foi a fonte mais eficiente para mudas de sabiá (Mimosa caesalpiniaefolia Benth.), conforme Marques et al. (2006); e para mudas de ipê-amarelo, jequitibá-rosa e jequitibá-branco, respectivamente numa dose média de 100, 100 e 140 mg/dm³ de N, respectivamente, de acordo com Goulart (2011).
Adubos fosfatados
Há vários adubos fosfatados no comércio, dos quais a maior parte da matéria prima é oriunda de minas, estes diferem quanto à concentração de fósforo, expresso em P2O5, e sua solubilidade, de modo que, quando mais solúvel maior seu aproveitamento (RAIJ, 2011; MALAVOLTA, 1979).
Na adubação fosfatada, além das doses e das fontes, o principal elemento a ser considerado é a fixação de P no solo que limita sua difusão até as raízes e pode ser abrandada com a redução da acidez, bem como, com a granulação dos adubos. Um aspecto positivo é que as perdas do P nos solos são muito pequenas e o índice salino é relativamente pequeno (MALAVOLTA, 1980).
Esse efeito de maior disponibilidade do fósforo, mediante a redução da acidez foi observado por Cardoso et al (2015) em mogno (Swietenia macrophylla King.) onde a adição de doses crescentes de P com aplicação de calcário favoreceram o crescimento inicial e o acúmulo de nutrientes das mudas.
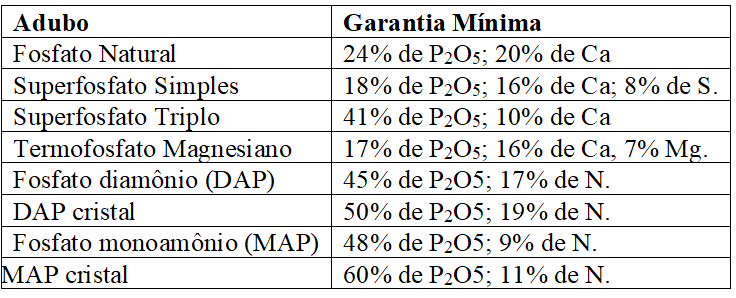
Os principais adubos fosfatados são os fosfatos de amônio, superfosfatos, termofosfato magnesiano e o fosfato natural. As especificações mínimas exigidas pelo MAPA (2007), para comercialização desses adubos, são apresentadas no Quadro 2:
Quadro 6 Adubos fosfatados e especificações mínimas exigidas para registro no MAPA.
O superfosfato simples é um dos mais aceitos na produção, pois apresenta importantes quantidades de enxofre e cálcio em forma móvel de sulfato, apesar da desvantagem do reduzido teor de P, encontrado em níveis superiores no superfosfato triplo; os fosfatos de amônio têm boas propriedades físicas e teores de fósforo superiores aos superfosfatos; já o termofosfato magnesiano é eficiente perante a acidez, enquanto os fosfatos naturais tem uso complexo, pois apresentam baixa solubilidade e longo período de liberação de fósforo (RAIJ, 2011; MALAVOLTA, 1979).
Daniel et al. (1997) analisando o crescimento de Acacia mangium WILLD diante da aplicação de diferentes fontes de fósforo, concluíram que o fosfato da Carolina do Norte não diferenciou em média ao superfosfato triplo, no entanto, o segundo tratamento proporcionou um crescimento mais rápido, enquanto o fosfato natural de Arad se mostrou o menos eficiente. Já Moreira, Malavolta e Moraes (2002) registraram que o termofosfato magnesiano Yoorin eleva o pH do solo, mas o superfosfato triplo o diminui e os fosfatos naturais apresentam reação neutra.
Quanto à resposta a doses perante a mesma fonte, OLIVEIRA e ALIXANDRE (2013) em estudo com sabiá (Mimosa caesalpiniifolia Benth) observaram que, com a elevação dos níveis de fósforo (0, 60, 120 e 240 mg dm-3) ocorreu maior crescimento das mudas e diminuição na taxa de colonização radicular por fungos micorrizícos arbusculares. Resultados parecidos foram registrados por Leite et al. (2014) em trabalho semelhante com mulungu (Erythrina velutina).
Adubos potássicos
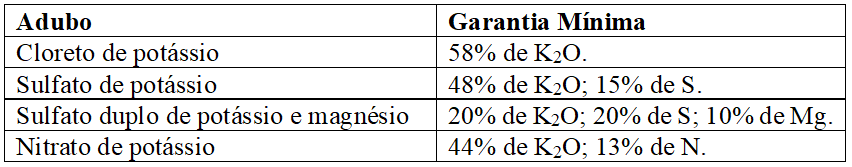
Os sais de potássio são obtidos de minas com misturas de cloretos e sulfatos de potássio, sódio, magnésio e cálcio após beneficiamento, destes o mais empregado no mundo é o KCl, mas também são produzidos o sulfato de potássio e o sulfato duplo de potássio e magnésio; outra fonte é o nitrato de potássio, obtido por reação entre ácido nítrico e cloreto de potássio, sendo todas essas fontes prontamente solúveis em água (RAIJ, 2011; MALAVOLTA, 1980; MALAVOLTA, 1979). As especificações mínimas exigidas pelo MAPA (2007), para comercialização desses adubos, encontram-se no Quadro 3:
Quadro 7 Principais adubos potássicos e especificações mínimas exigidas para registro no MAPA.
Silva et al. (1997) estudando a resposta de quatorze espécies florestais à adubação potássica, constataram que houve incrementos significativos na produção de matéria seca nas espécies pioneiras avaliadas, (canafístula, pau-cigarra; ipê-de-jardim, jacarandá-mimoso, mutamba e candiúba) exclusa cássia-carnaval, bem como, nas espécies secundárias cedro e fedegoso, enquanto as espécies de clímax estudadas não responderam a adubação potássica; já Reis et al. (2012) relataram respostas negativas à adubação potássica em jacarandá-da-bahia para a maioria das características avaliadas; em contrapartida, a adição de doses crescentes de potássio ao substrato apresentou resposta significativa (quadrática) para todas as variáveis avaliadas em mudas de vinhático (Platymenia foliolosa) por Duarte et al. (2015), exceto para a relação altura da parte aérea/diâmetro de coleto.
Adubos contendo cálcio, magnésio e enxofre.
O suprimento adicional de cálcio em solos ácidos é feito em níveis maiores que o necessário às plantas no processo de calagem, mas, quando a correção de acidez não é necessária, esse elemento pode se encontrar em níveis insuficientes, sendo importante o uso de fertilizantes que apresentam o cálcio como constituinte, é o caso dos superfosfatos simples (16% de Ca), triplo (10% de Ca), os fosfatos naturais (38% de Ca) e o termofosfato (16% de Ca), onde há principalmente fornecimento de fósforo, mas ocorre conjuntamente a outros nutrientes, como o cálcio (MALAVOLTA, 1980; MAPA 2007), contudo, há sais de cálcio dos quais o principal é o sulfato de cálcio (16% de Ca), no qual este é o principal elemento fornecido, outro sal é o cloreto de cálcio (24% de Ca) (RAIJ, 2011).
Já quanto ao magnésio, o sal mais comum seria o sulfato de magnésio (9% de Mg), mas assim como o cálcio, o elemento se encontra disponíveis em fertilizantes em que não é o principal componente, é o caso do termofosfato magnesiano (7% de Mg) e o sulfato de potássio e magnésio (10% de Mg), teores comumente suficientes. Outras fontes de magnésio são o óxido (45%) e o carbonato de magnésio (25% de Mg), corretivos de acidez. (MALAVOLTA, 1980; RAIJ, 2011; MAPA, 2007)
E sobre o enxofre, sua forma elementar (95% de S) pode ser usada como fonte, contudo, sua disponibilidade ocorre na forma de ácido sulfúrico sendo recomendado o uso em solos alcalinos como corretivo de pH. (RAIJ, 2011). Em outras situações, o elemento é fornecido indiretamente, por meio de fertilizantes que se destinam a fornecer outro nutriente, é o caso do superfosfato simples (8% de S) e os sulfatos de amônio (22% de S), de potássio (15% de S), de potássio e magnésio (20% de S), de magnésio (11% de S) e de cálcio (13% de S) (RAIJ, 2011; MALAVOLTA, 1980; MAPA, 2007).
Em trabalho com sabiá (Mimosa caesalpiniaefolia Benth.), Gonçalves et al. (2010) observando o efeito de doses de macronutrientes sobre mudas cultivadas em diferentes tipos de solo (Argissolo vermelho-amarelo – AV, Latossolo vermelho-amarelo álico – LVA e Latossolo vermelho-amarelo distrófico – LVD) e relataram sobre adições de cálcio. Efeitos só foram significativos quanto à altura das mudas cultivadas no substrato LVA, em que a quantidadede cálcio era inferior aos demais substratos, indicando a dose de 1,4 cmolc dm-3 de Ca, uma evidência de que, a espécie em questão é pouco exigente quanto ao fornecimento desse nutriente.
Já o fornecimento de magnésio apresentou-se como prejudicial a várias características, influenciadas negativa e linearmente pela adição do elemento ao meio, exceção encontra-se sobre a altura nas mudas cultivas em LVA nas quais houve aumento dos valores de altura em consequência do aumento das doses aplicadas, mas sobre as demais características os efeitos não foram significativos.
A respeito do enxofre, em todas as características avaliadas, houve diferenças no crescimento das mudas de sabiá, em virtude da aplicação de doses de enxofre no LVD, porém nos demais substratos, só foram detectadas diferenças significativas para o crescimento em altura.
Adubos contendo micronutrientes
Os seis micronutrientes requeridos pelas plantas (B, Cu, Fe, Mn, Mo, Zn) ramificam-se em três grupamentos: quatro metais (Cu, Fe, Mn e Zn) que reagindo a ácidos formam compostos de ânions solúveis em água (acetato, cloreto, formiato, fosfato, nitrato e sulfato); Molibdênio de caráter aniônico, apesar de metal e de fontes solúveis em água; e Boro, solúvel na forma de ácido bórico, e insolúvel na forma de bórax e colemanita (RAIJ, 2011).
As aplicações conforme Malavolta (1980) podem ser feitas através de um tratamento prévio das sementes e por aplicação foliar ou no solo.
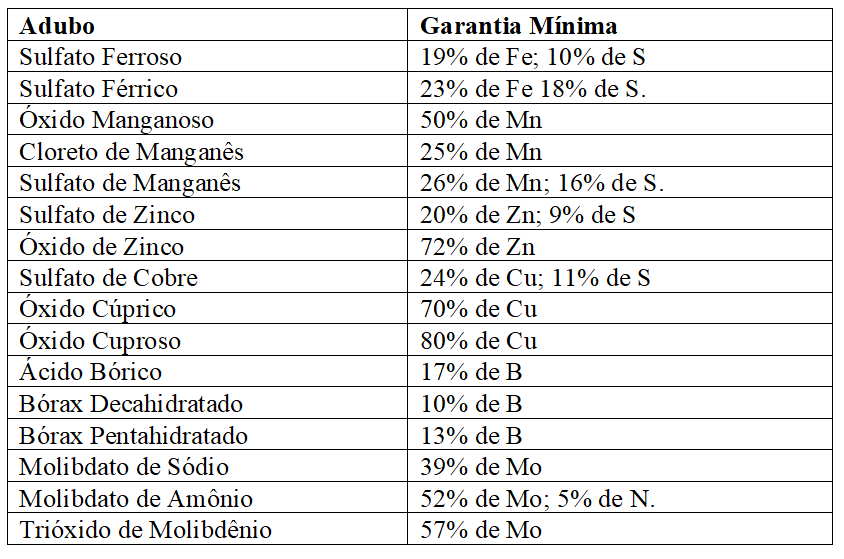
As especificações mínimas exigidas pelo MAPA (2007), para comercialização de adubos contendo micronutrientes, encontram-se no Quadro 4:
Quadro 8 Principais adubos com micronutrientes e especificações mínimas exigidas para registro no MAPA.
Outras fontes são multielementares como os quelatos solúveis em água que podem ser usados tanto por aplicação foliar como no solo; e as chamadas fritas, preparadas por fusão da sílica com os micronutrientes de uso exclusivo ao substrato liberando lentamente seus elementos. (RAIJ, 2011; MALAVOLTA, 1981)
A partir da aplicação da técnica de diagnose por subtração, Renó et al. (1997) constaram a necessidade de fornecimento de micronutrientes, em Latossolo Vermelho-Amarelo, ao jucá (Caesalpinia leiostachya (Benth.) Ducke) que apresentou limitações ao crescimento perante omissão de micronutrientes; já em paricá (Schizolobium amazonicum Herb) a partir do uso da mesma técnica Marques et al.(2004) descrevem o ferro como um dos elementos mais limitantes ao crescimento das mudas; enquanto em sangra d’água (Croton urucurana Baill.) a maior redução no desenvolvimento, em altura e diâmetro do colo foi causada pela ausência de B, Mn e Zn conforme apresentado por Sorreano et al. (2008).
Adubação Orgânica: Fontes e Efeitos.
Tem-se por adubos orgânicos, compostos originados de tecido vegetal ou animal contendo um ou mais elementos essenciais que comumente são disponibilizados de forma lenta para as plantas e irão variar conforme a origem do material e manuseio (MALAVOLTA, 1981; RAIJ, 2011).
Apesar da atenção voltada principalmente a esse caráter de contribuição à nutrição vegetal, os adubos orgânicos apresentam outras funcionalidades, como acréscimos ao armazenamento de água e CTC, regulação do pH e melhorias das propriedades físicas do solo, outro papel é servir de alimento à biota presente no substrato, em virtude de um de seus principais constituintes: o carbono (MALAVOLTA, 1981; SILVA; MEDONÇA, 2007).
Nesse sentido, deve-se atentar a relação carbono/nitrogênio, ao considerar o nitrogênio necessário aos indivíduos que compartilham o mesmo sítio das raízes, os microrganismos absorvem para cada trinta partes de carbono, uma parte de nitrogênio, de modo que, materiais com alta C/N podem provocar déficit de nitrogênio, em virtude da competição dos microrganismos com as raízes pelo elemento (CARNEIRO, 1995; KIEHL, 1985).
A adubação orgânica provém por tradição da decomposição de uma mistura de vegetais oriunda da adubação verde, turfa, serapilheira de povoamentos adultos, estercos, casca de vegetais de diferentes origens através da ação de microrganismos e da fauna do solo, ou seja, a compostagem, onde o material é heterogêneo, impossibilitando o controle com rigor desses nutrientes (RAIJ, 2011; CARNEIRO, 1994; PENTEADO, 2010).
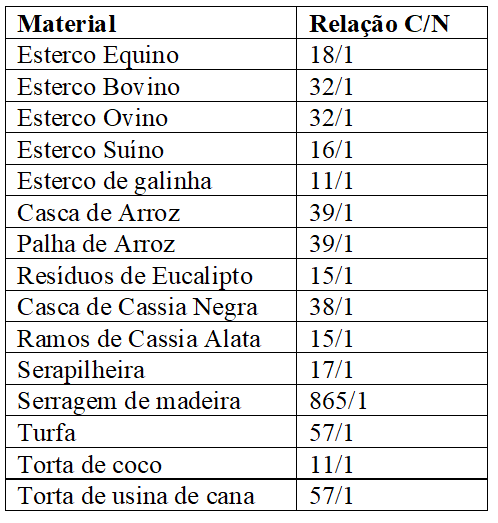
Penteado (2010) afirma que, tal prática possibilita a melhoria do aproveitamento de materiais com relação em desequilíbrio, pois, em mistura, haverá uma proximidade a relação C/N indicada que varia de 25 a 30/1. O Quadro 5 apresenta a relação C/N de alguns desses materiais, conforme apresentado Kiehl (1985):
Quadro 9 Alguns materiais usados como adubos orgânicos e relação carbono/nitrogênio esperada (Kiehl, 1985).
Em estudo com Acacia mangium e Acacia auriculiformis utilizando sementes inoculadas com rizóbio e não-inoculadas, Cunha et al. (2006) compararam a adubação mineral (160, 640 e 160 g m-3 de N, P2O5 e K2O, respectivamente), e diferentes fontes de orgânicas (esterco bovino e lodo de esgoto), acrescidos ao substrato constituído por horizonte Bw e areia lavada(1:1:1), bem como, um tratamento constituído unicamente por lodo de esgoto; e observaram que o substrato composto de lodo de esgoto 100% com sementes inoculadas proporcionou maior desenvolvimento às mudas de ambas espécies, mas dentre os substratos com a mesma proporção (horizonte Bw + areia lavada + tratamento) o tratamento superior foi aquele no qual foi feito o uso de esterco bovino.
Keil; Reissmann; Pellico Netto (2010) também relatam a superioridade da adubação orgânica a partir de esterco bovino curtido para todos os caracteres avaliados, em estudo por período de dois anos com canela-sassafrás (Ocotea odorifera (Vell.) Rohwer), no qual os outros tratamentos consistiam em um fornecimento completo de nutrientes, e os demais por supressões individuais dos nutrientes (-N, -P, -K, -Ca, -Mg, -S, -B, -Zn).